成果介绍
利用蛋白质结构建模设计增强NK细胞杀伤活性的嵌合受体
作者:郭长江 时间:2019-07-11

在河南省重大科技专项(批准号:161100310900)和 河南省高等学校重点科研项目(批准号:19A180026)等资助下,本研究团队在在提高嵌合抗原受体(CAR)理性设计研究领域取得进展。研究成果以“一种新型嵌合PD1-NKG2D受体的结构理性设计用于自然杀伤细胞(Structure-based rational design of a novel chimeric PD1-NKG2D receptor for natural killer cells)”为题,于2019年07月发表于《分子免疫学》(Molecular Immunology)。论文链接:DOI:10.1016/j.molimm.2019.07.009。
【摘要】
嵌合抗原受体(CAR)工程化的自然杀伤细胞(NK细胞)具有潜力提供实施异基因“现货”细胞疗法来对抗癌症。目前,大多数CAR并未针对NK细胞进行优化,因此需要新的专为NK细胞设计的CAR。在这里,利用NK细胞的主要激活受体NKG2D,设计了不同的嵌合受体,介导强烈的NK细胞信号传导。在这些基于NKG2D信号传导的嵌合受体中,采用了抑制性受体PD-1的细胞外区域,以逆转PD-1配体在实体瘤中介导的免疫逃逸。为了实现嵌合PD1-NKG2D受体的理性设计,我们开发了一种膜蛋白三维结构预测程序(PredMP和I-TASSER),并通过改变铰链区和胞内区域的序列来优化PD-1胞外区构象。最终,我们确定了一个包含NKG2D铰链区域和4-1BB共刺激区域的嵌合PD1-NKG2D受体,能够表现出稳定的表面表达,并在体外介导NK92细胞对多种肿瘤细胞的细胞毒作用。这一策略现在为采用计算机辅助设计(CAD)的强效NK细胞定制的NKG2D信号传导嵌合受体提供了有希望的方法。
【研究背景】
该研究关注肿瘤细胞免疫疗法,尤其是嵌合抗原受体(CAR)修饰免疫细胞在治疗肿瘤方面的应用。然而,由于需要采集和基因修改每位患者的T细胞,自体细胞CAR-T疗法成本高且劳动密集,有时会影响患者的治疗。自然杀伤(NK)细胞在对抗病毒感染和癌症方面发挥着关键作用,并且是CAR疗法中T细胞的替代选择之一。CAR-NK细胞不会像CAR-T疗法中那样出现细胞因子释放综合症(CRS)等副作用。然而,由于NK细胞的大规模扩展存在困难,CAR-NK免疫疗法的发展仍处于早期阶段。为了解决这个问题,已经建立了不断扩增的人类NK细胞系(如NK92细胞)和iPSC衍生的NK细胞。具有对恶性细胞具有细胞毒活性且副作用最小的NK细胞被认为是理想的同种异体效应细胞,可提供“现货”细胞免疫疗法。
大多数CAR组分,特别是信号结构域,都源自T细胞受体信号结构域,需要针对NK细胞信号进行优化。将NK细胞激活受体整合进CAR-NK细胞中可能会增强其细胞毒性。在人体内,NKG2D是NK细胞的关键激活受体,可清除受到压力、恶性转化和感染的细胞,因此它为构建适用于NK的CAR提供了出色的潜力。然而,由于NKG2D在其胞内结构域中缺乏信号结构,只能在与其跨膜信号适配蛋白DAP10结合时传递信号。然而,由于NKG2D是一种具有与当前CAR平台方向相反的II型跨膜蛋白,因此采用NKG2D跨膜域将改变其他CAR元素的构型和功能,而且由于NKG2D蛋白的固有不稳定性,迄今为止,采用NKG2D跨膜域来介导NK细胞激活仍然具有挑战性。此外,为了优化CAR信号与NK细胞中的NKG2D的配合,有必要整合4-1BB(CD137)的共刺激结构域。共刺激分子4-1BB可以在人体中调节NKG2D共刺激,并通过激活下游信号通路改善NK细胞基础CAR的功能(激活、增殖和持久性)。
研究中通过合理设计一系列基于PD1-NKG2D的嵌合受体,主要基于三维结构预测,利用自然NKG2D信号诱导NK92细胞强大的细胞毒活性。这些嵌合受体的骨架通过将PD-1的外区域与NKG2D的跨膜区域融合而构建。这些嵌合PD1-NKG2D受体旨在将负面的PD-1信号转变为激活信号,从而逆转PD-1在与实体瘤中其配体相互作用时的免疫抑制效应。重要的是,研究首次演示了如何通过三维结构建模跨膜蛋白来减少NKG2D跨膜结构对嵌合受体相邻区域的构象和功能的干扰。最终,工程化表达了带有NKG2D铰链区域和4-1BB胞内区域的chPN受体的NK92细胞表现出稳定的表面表达,并对人类肺癌细胞展现出强大的体外细胞毒性。
【研究内容】
本研究利用蛋白质结构预测方法PredMP和I-TASSER,构建了PD-1和嵌合PD1-NKG2D受体的跨膜蛋白三级结构模型(图1A)。发现NKG2D铰链区可减轻PD-1结构域的构象干扰。
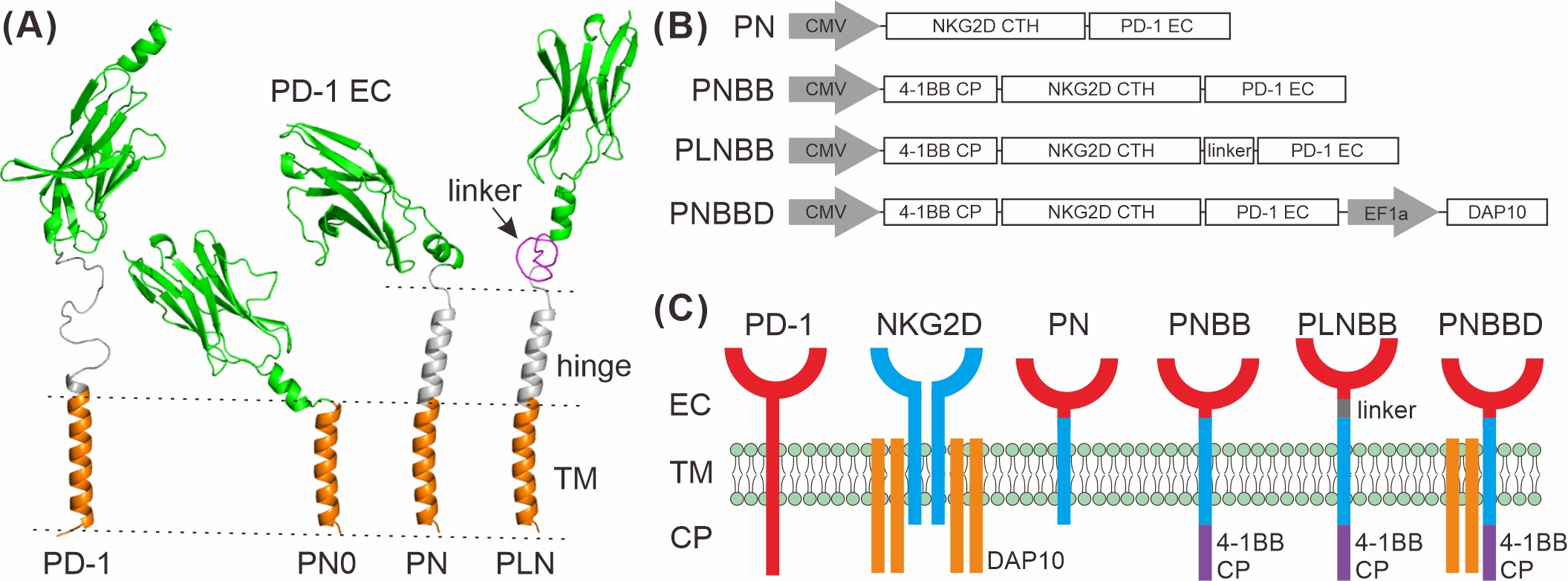
图1. 基于蛋白质结构建模的嵌合PD1-NKG2D (chPN) 受体的合理设计和构建。(A)野生型PD-1和chPN受体的跨膜域和胞外域的3D结构。模型是根据人PD-1结构(PDB:5IUS)由PredMP和I-TASSER构建的。PD-1的胞外域,PD-1和NKG2D的跨膜域,以及NKG2D的铰链区分别以绿色,橙色和灰色表示,GS柔性肽段以洋红色表示。(B)各种chPN受体的示意图。每个启动子由灰色箭头表示。(C)野生型PD-1,NKG2D-DAP10复合物和各种chPN受体的示意图。
我们根据蛋白质结构模型设计了4种嵌合受体,包括:PN、PLN、PNBB和PNBBD(图1B),其中仅PNBB可稳定表达于NK92细胞表面(图2)。
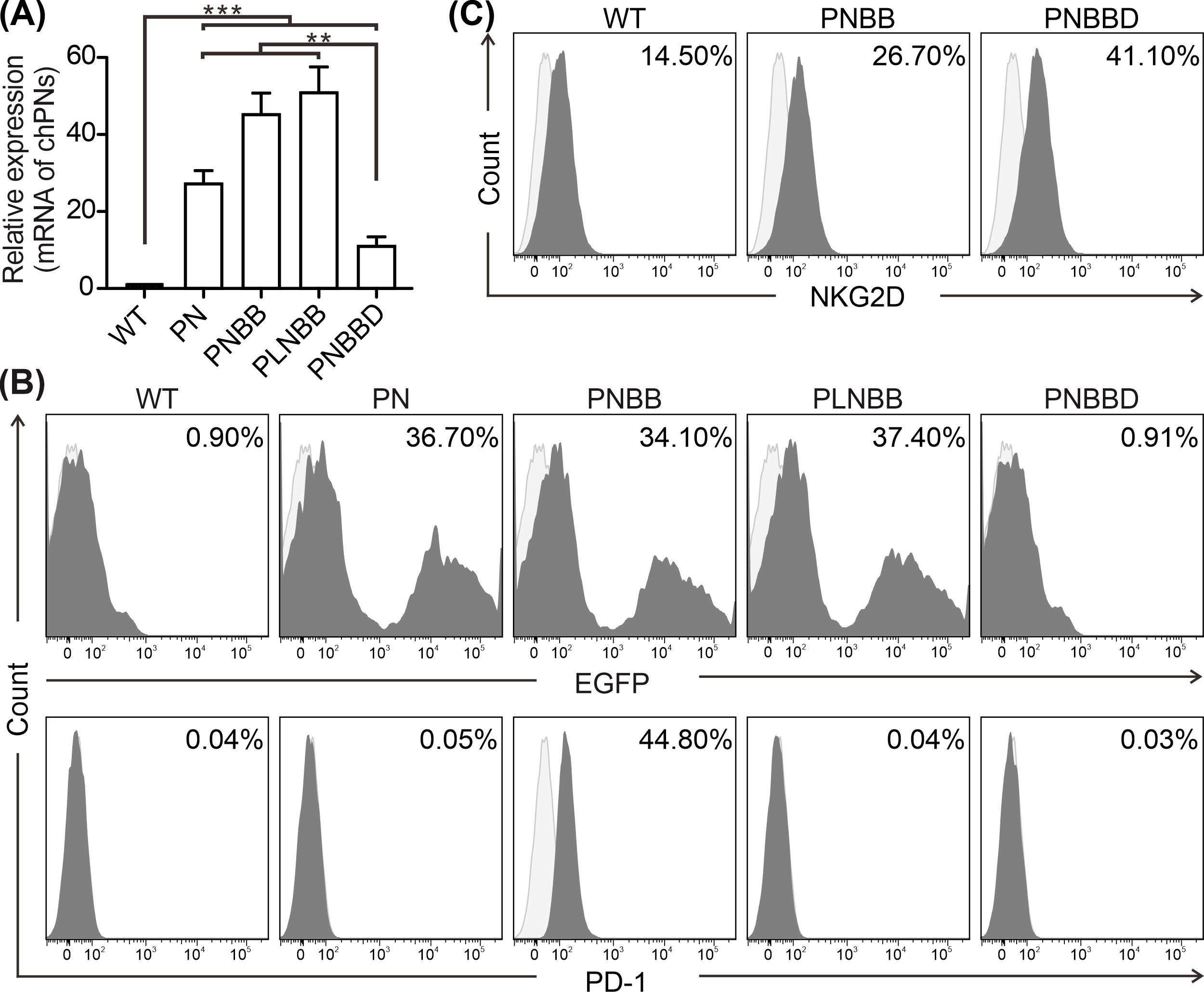
图2. 各种NK92细胞中chPN受体的表达。(A)未经转染(WT)和经转染NK92细胞中嵌合受体基因的相对转录表达。(B-C)未经转染(WT)和转染的NK92细胞中PD-1外区域(B)和NKG2D(C)的EGFP表达和表面表达,通过流式细胞术进行评估。使用抗PD1单抗和抗NKG2D单抗染色未经转染或经各种嵌合PN受体转染的NK92细胞。
研究表明PNBB-NK92细胞对表达高水平PD-L1的人肺癌细胞H1299具有明显的杀伤活性,而对PD-L1阴性的A549细胞没有杀伤作用(图3)。我们发现PNBB-NK92细胞可能通过诱导肿瘤细胞发生焦亡快速清除H1299细胞。此外,PNBB-NK92细胞对其他PD-L1阳性肿瘤细胞也表现出增强的杀伤活性(图3D)。
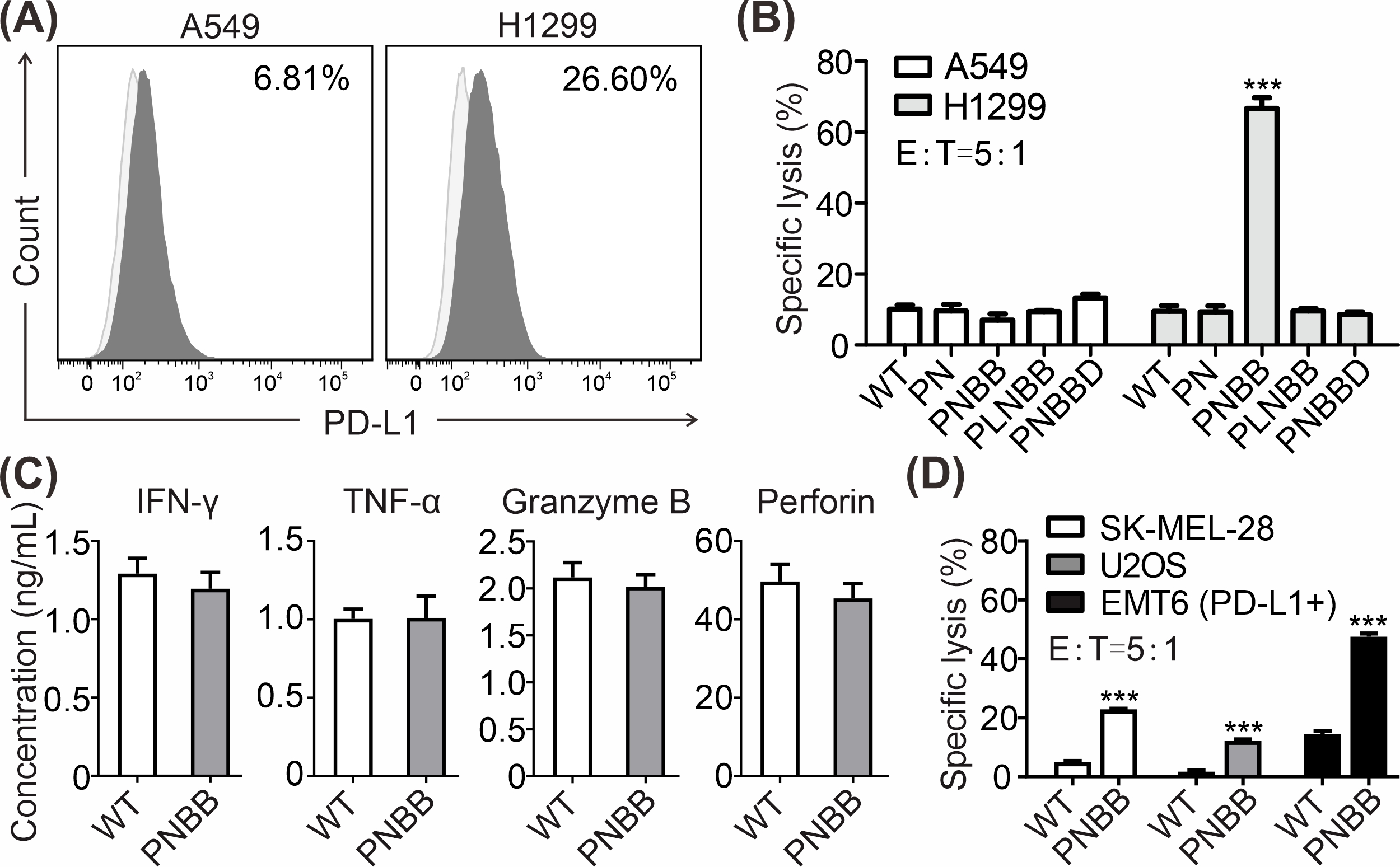
图3. 转染NK92细胞的细胞毒活性和细胞因子分泌。(A 通过流式细胞术评估A549和H1299肺癌细胞系中PD-L1的表面表达。(B)通过LDH释放细胞毒性实验测定未经转染(WT)或转染NK92细胞对A549和H1299细胞的特异裂解。(C)在未经转染(WT)NK92细胞和PNBB-NK92细胞与H1299肿瘤细胞共培养后,通过ELISA评估IFN-γ,TNF-α,疏松素B和穿孔素的产生。(D)LDH释放细胞毒性实验测定未经转染(WT)NK92细胞和PNBB-NK92细胞对肿瘤细胞的特异裂解。
【研究意义】
本研究发现合理应用蛋白质结构建模技术可指导嵌合受体的高效设计,比如减少II型跨膜蛋白NKG2D融合对嵌合受体构象的影响。所设计的PNBB受体稳定表达于NK92细胞表面并增强其杀伤肿瘤活性,为设计增强NK细胞功能的CAR提供了新策略,有望成为一种抗肿瘤的“现成”免疫细胞疗法。
(文/郭长江 图/郭长江)
