成果介绍
嵌合抗原受体改造NK细胞抗肿瘤新发现:激活肿瘤细胞焦亡
作者:郭长江 时间:2020-04-05

在河南省重大科技专项(批准号:161100310900)和国家自然科学基金项目(批准号:81903187)等资助下,本研究团队在人工受体工程化NK细胞抗肿瘤机制研究领域取得进展。研究成果以“一种新型的PD1-NKG2D-41BB嵌合受体通过触发细胞焦亡途径增强NK92细胞对人肺癌H1299细胞的抗肿瘤活性(A novel chimeric PD1-NKG2D-41BB receptor enhances antitumor activity of NK92 cells against human lung cancer H1299 cells by triggering pyroptosis)”为题,于2020年4月发表于《分子免疫学》(Molecular Immunology)。论文链接:DOI:10.1016/j.molimm.2020.04.016。
【摘要】
嵌合抗原受体(CAR)修饰的自体自然杀伤细胞(NK细胞)代表了一种在癌症治疗中具有潜在前景的免疫治疗方法,但在实体瘤中面临许多挑战。一个主要障碍是由抑制性受体(IR),包括PD1,引起的免疫抑制效应。为了干预PD1信号以增强CAR-NK细胞对实体瘤的活性,我们理性设计了一种新型的嵌合共刺激转换受体(CCCR),主要包括PD1的细胞外区域、NKG2D的跨膜和胞质区域,以及41BB的胞质区域。这种专为NK细胞定制的CCCR能够将负面的PD1信号转换为激活信号,从而逆转PD1的免疫抑制效应。经过CCCR修饰的NK92细胞(CCCR-NK92)保留了典型的NK细胞特征,并在体外与未转染的NK92细胞相比,对人肺癌H1299细胞表现出增强的抗肿瘤活性。CCCR-NK92细胞引起的细胞焦亡是对H1299细胞的迅速清除原因之一。在肺癌异种移植模型中,CCCR-NK92细胞显著抑制了肿瘤生长。我们的结果突显了使用经过NK定制的CCCR工程化NK92细胞治疗人肺癌的潜在免疫治疗潜力。
【研究背景】
嵌合抗原受体(CAR)修饰的免疫细胞是一种新兴的肿瘤免疫治疗方式。但CAR-T细胞治疗实体肿瘤的疗效较差,实体肿瘤微环境中的免疫抑制是主要障碍之一。肿瘤高表达PD-L1与T细胞表面的PD-1结合会抑制T细胞活性。研究人员设计了一种新型的CAR受体,旨在通过激活NK细胞的活化信号途径,增强其对肿瘤的杀伤作用。
【研究内容】
我们设计了一种嵌合共刺激转换受体CCCR,其核心结构包含PD-1胞外结构域、NKG2D跨膜结构域和4-1BB细胞内结构域。将CCCR导入NK92细胞生成CCCR-NK92细胞,CCCR的表达没有改变NK92细胞的主要分子表型特征。
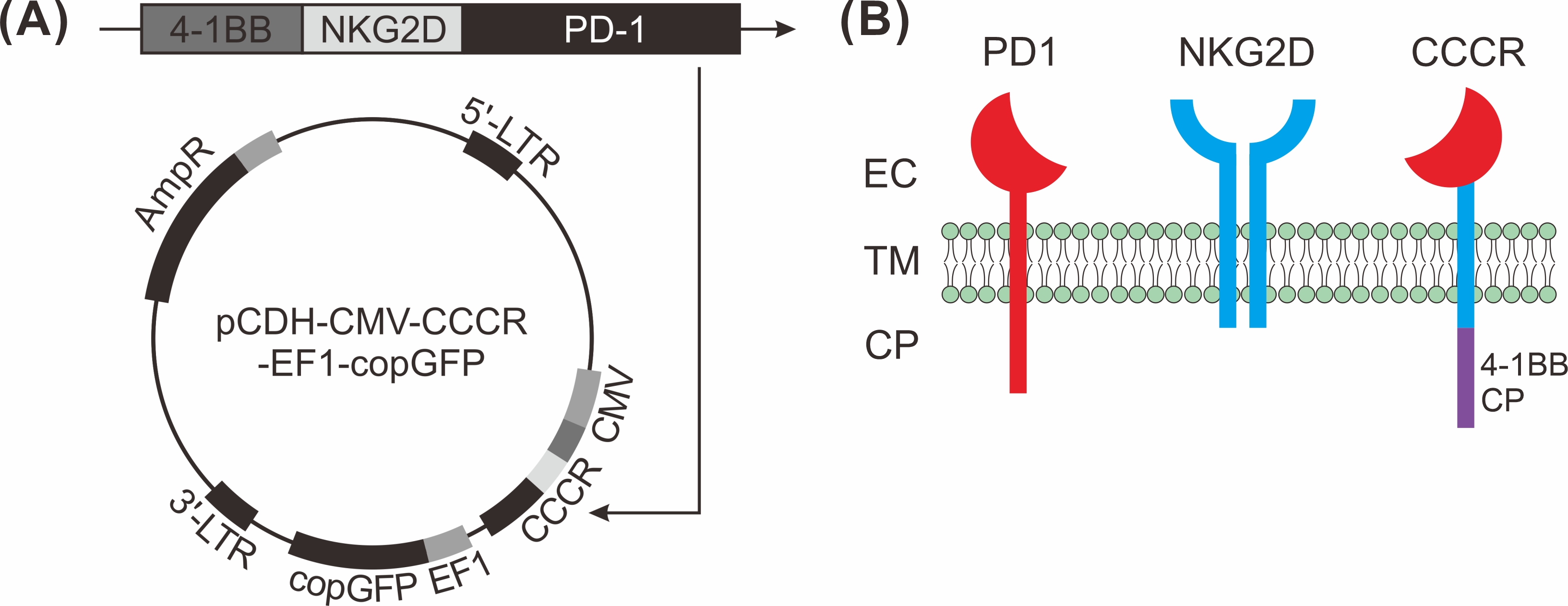
图1. 嵌合共刺激转换受体(CCCR)的构建。(A)CCCR载体构建示意图。 CCCR包含PD1的细胞外区域、NKG2D的跨膜区域和胞质区域以及4-1BB的胞质区域。此基因片段被克隆到慢病毒载体pCDH-CMV-MCS-EF1-copGFP中。(B)PD1、NKG2D和CCCR在细胞表面的示意图。
研究结果显示CCCR-NK92细胞对PDL1阳性的人肺癌细胞H1299表现出增强的杀伤活性。因此,本研究构建的CCCR可将PD-1的抑制信号转变为激活信号,逆转肿瘤诱导的免疫抑制作用。
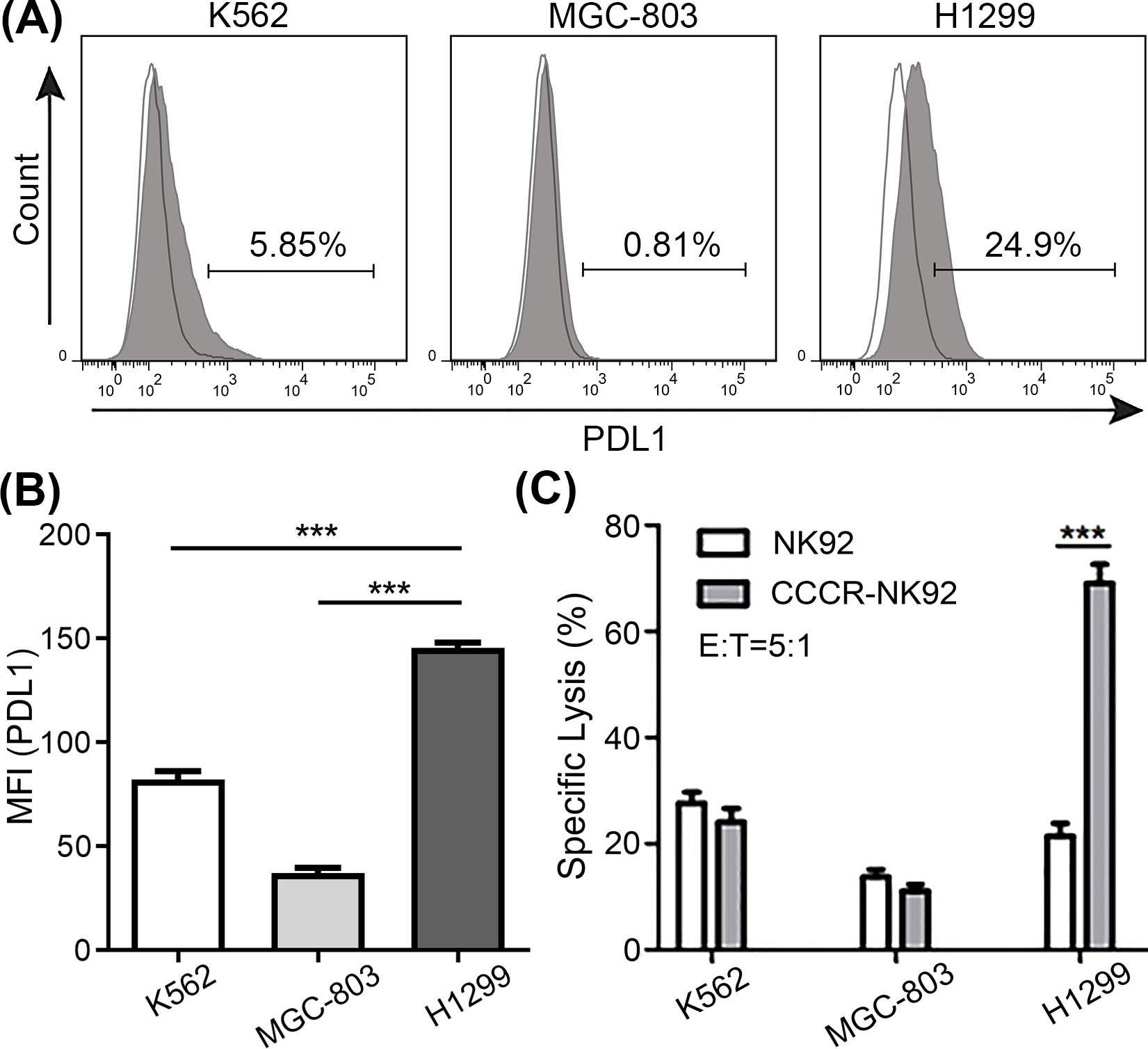
图2. CCCR-NK92细胞对肿瘤细胞的体外细胞毒作用。(A)通过流式细胞术评估K562、MGC-803和H1299细胞中PDL1的表面表达。(B)通过流式细胞术分析K562、MGC-803和H1299细胞中PDL1的平均荧光强度(MFI)。(C)通过LDH释放细胞毒性实验进行测量NK92和CCCR-NK92细胞对K562、MGC-803和H1299细胞的杀伤活性。
进一步研究发现CCCR-NK92细胞能快速清除H1299细胞是通过诱导H1299细胞发生细胞焦亡实现的。我们在肿瘤裸鼠模型中验证了CCCR-NK92细胞可明显抑制H1299肿瘤的原位生长。
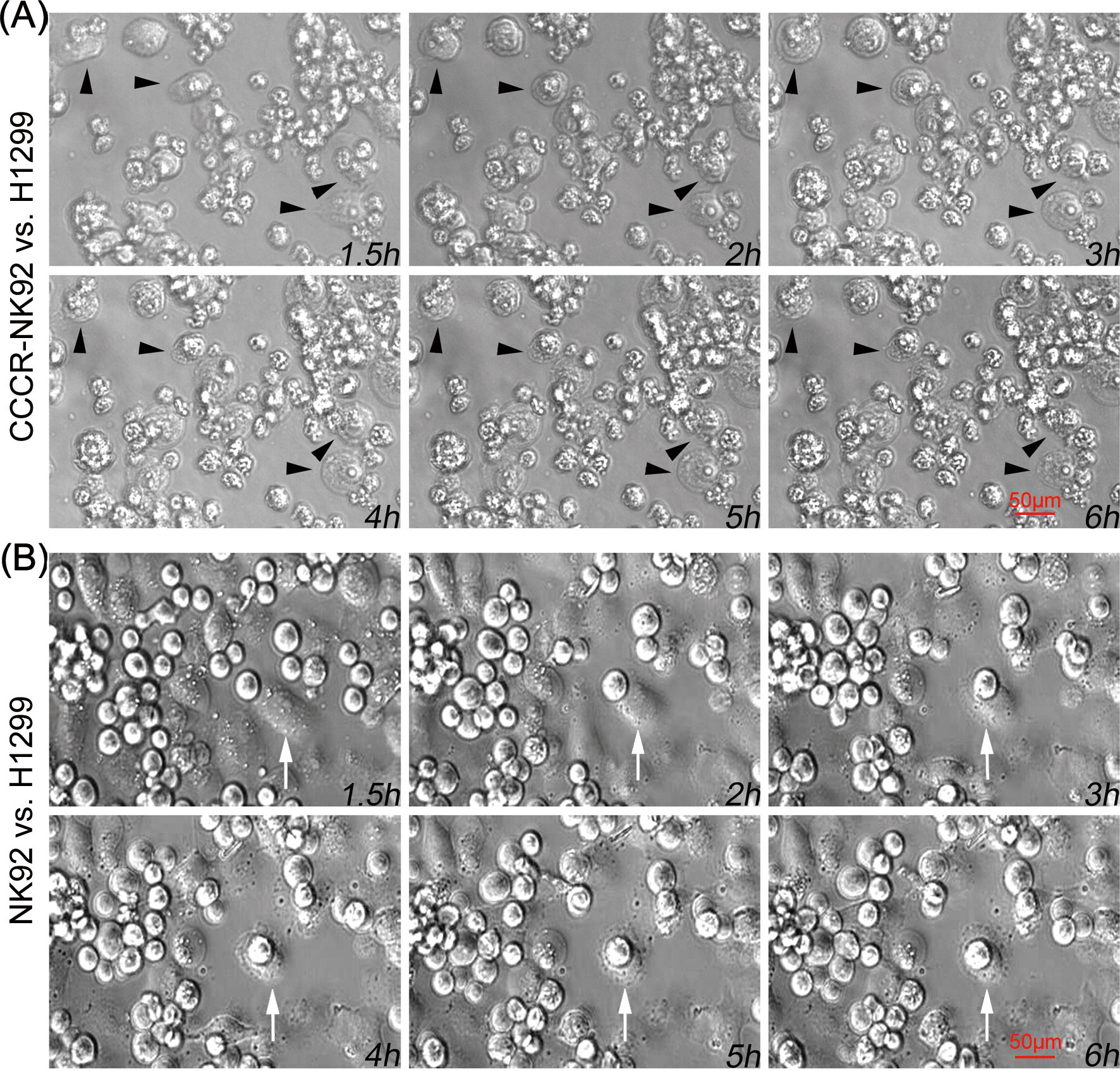
图3. 高内涵成像系统分析CCCR-NK92细胞(A)和未转染NK92细胞(B)对H1299细胞的细胞毒作用过程。每张照片右下角显示孵育后的时间(小时)。壁附癌细胞和火凤凰死亡的癌细胞分别由白色箭头和黑色箭头标示。
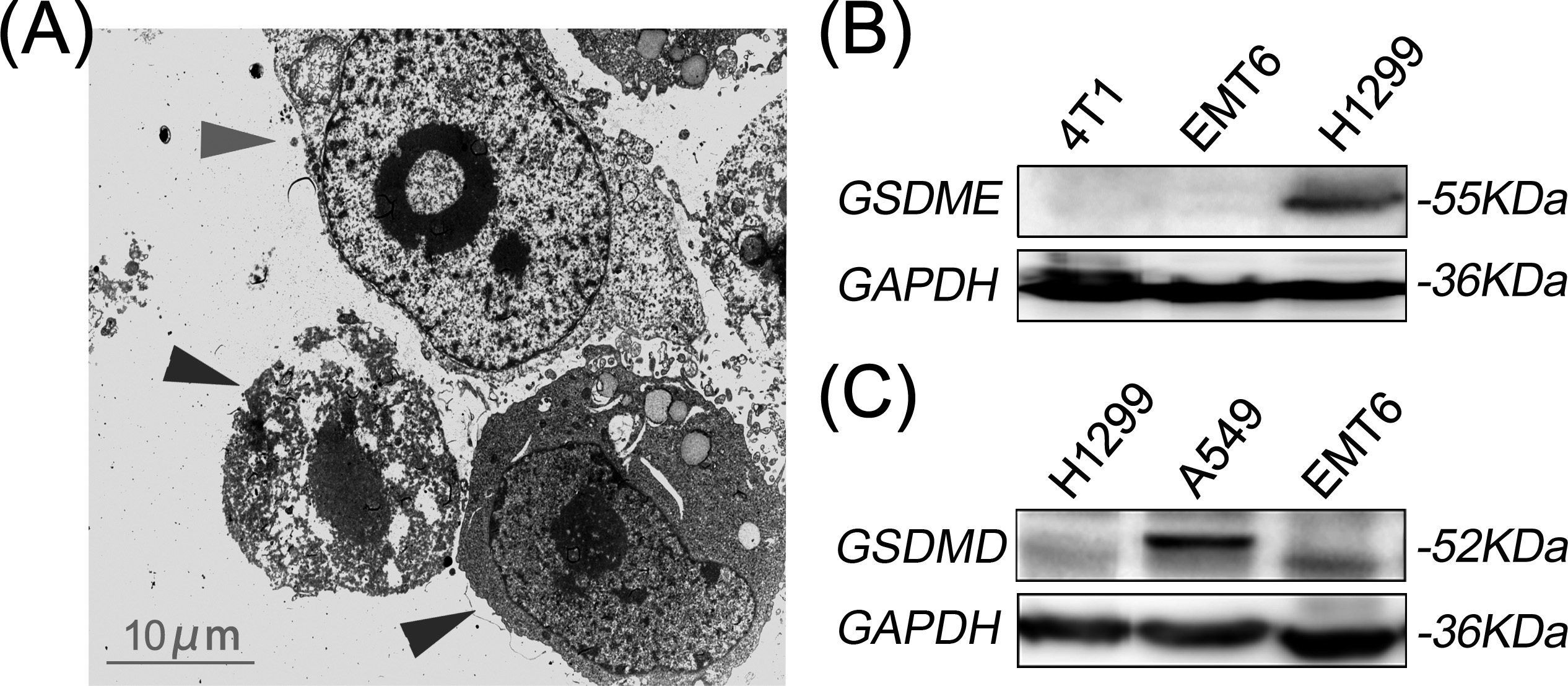
图4. CCCR-NK92细胞诱导的肿瘤细胞焦亡。(A)CCCR-NK92细胞共培养4小时的H1299细胞的透射电子显微图像。红色箭头标示CCCR-NK92细胞。蓝色箭头标示具有膜破裂和细胞萎缩的焦亡H1299细胞。肿瘤细胞系中GSDME(B)和GSDMD(C)的测定通过Western blot进行。
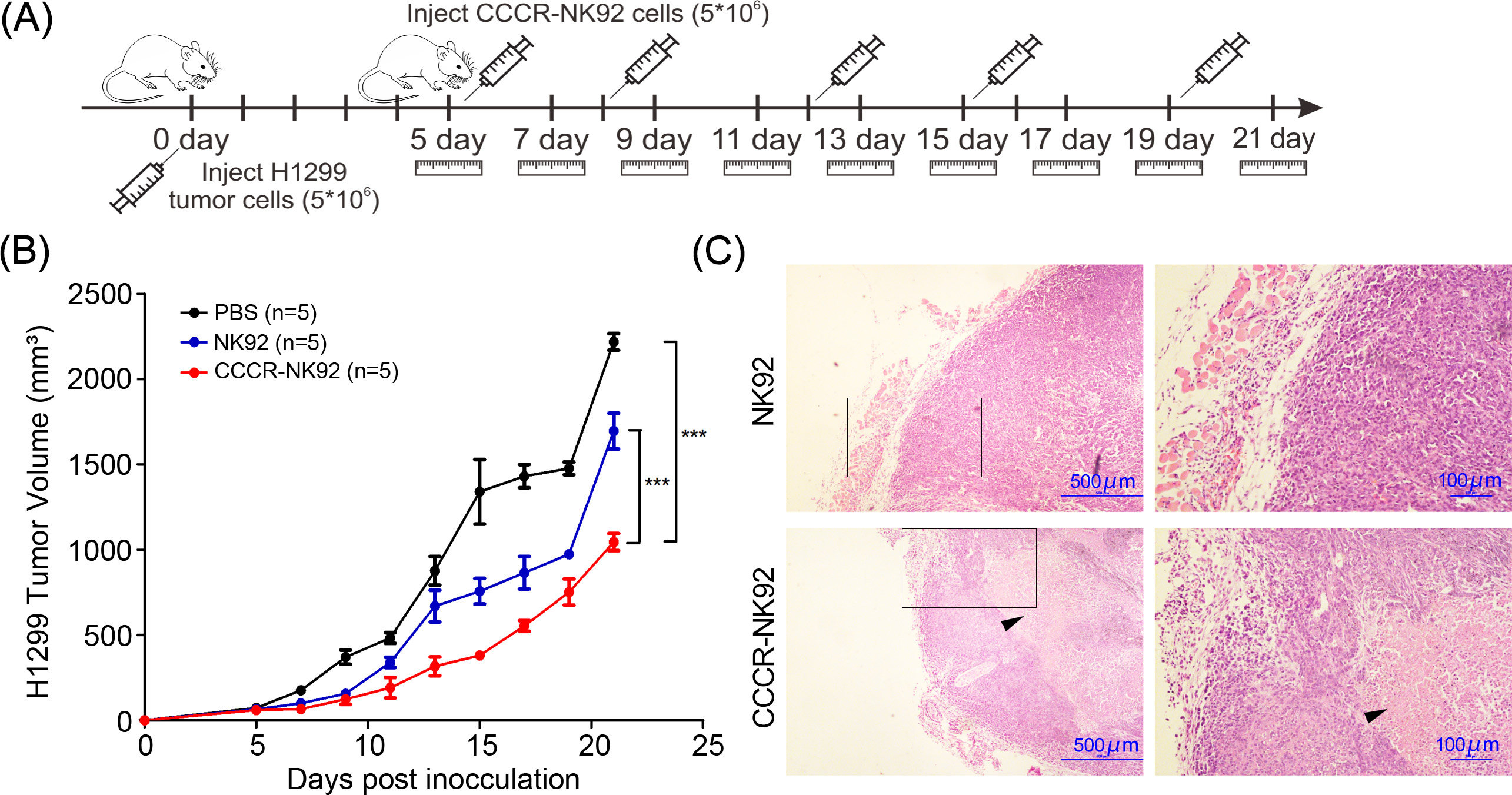
图5. CCCR-NK92细胞对肺癌的体内抗肿瘤活性。(A)使用H1299肺肿瘤细胞的小鼠异种移植模型,通过PBS、NK92细胞和CCCR-NK92细胞进行体内研究的示意图。(B)每组肿瘤体积在NK92或CCCR-NK92细胞输注后的21天内进行监测。(C)每个治疗组肿瘤组织的H&E染色图像。黑色箭头标示肿瘤坏死区域。
【研究意义】
本研究发现CCCR可逆转PD-1/PD-L1的免疫抑制作用,增强NK细胞对肿瘤的杀伤功能,为CAR-NK细胞疗法在实体瘤治疗中克服固态肿瘤微环境的免疫抑制提供了新策略。本文首次发现CAR-NK细胞可诱导靶向肿瘤细胞发生焦亡。这为CAR-NK细胞的杀伤机制提供了新见解。CCCR-NK92细胞系可望成为一种抗肺癌的通用异体细胞免疫疗法,为NK细胞应用于肿瘤免疫治疗提供了新思路。
(文/郭长江 图/郭长江)
