成果介绍
采用NK细胞定制病毒载体大幅提升CAR-NK细胞的杀伤肿瘤能力
作者:郭长江 时间:2023-03-10
在国家重点研发计划(批准号:2019YFA0906000)和国家自然科学基金项目(批准号:82003261)等资助下,本研究团队在自然杀伤(NK)细胞慢病毒载体优化改造研究领域取得进展。研究成果以“使用优化的慢病毒载体增强CAR在人NK细胞中的表达和细胞毒性(Engagement of an optimized lentiviral vector enhances the expression and cytotoxicity of CAR in human NK cells)”为题,于2023年03月01日发表于《分子免疫学》(Molecular Immunology)。本研究论文通过对经典的慢病毒载体pCDH进行结构优化,成功制备出嵌合抗原受体(CAR)表达水平显著提高的CAR修饰自然杀伤细胞(CAR-NK细胞),并表现出大幅增强的杀伤肿瘤细胞的体外活性。这一研究为提升CAR-NK细胞在肿瘤免疫治疗中的疗效提供了新的思路。论文链接:https://doi.org/10.1016/j.molimm.2023.01.010。

【研究背景】
癌症是一种严重的疾病,在全球范围内影响着数百万人。传统的化疗和放疗等传统治疗对身体存在较大的副作用,且效果通常有限。近年来,一种称为嵌合抗原受体(CAR)修饰的T或NK细胞(CAR-T/NK)的新型癌症治疗方法应运而生。CAR-NK细胞是一种通过基因工程使NK细胞表面表达CAR而获得特异识别并杀伤肿瘤细胞的能力的细胞工程产品。研究者通常用含有CAR基因的慢病毒载体感染NK细胞来制备CAR-NK细胞。但目前大多数CAR-NK细胞表面CAR的阳性表达率不到50%。因此,CAR-NK细胞治疗的有效性受到CAR低表达的限制,远不能满足临床需要。为了解决这一问题,研究团队一直在探索改善CAR-NK细胞转染和制备质量的方法。
【研究内容】
我们发现采用双启动子的慢病毒载体pCDH制备CAR-NK细胞中CAR表达较低,且经抗性筛选可提高报告基因的表达而CAR的表达水平仍然很低。为提高CAR的表达水平,我们将pCDH载体的第二启动子EF1替换为自切割肽P2A序列,获得优化后的单启动子载体pCDHsp。结果证实pCDHsp可在转导NK细胞后使CAR与GFP的表达高度一致并协同提升。筛选后,pCDHsp-CAR-NK细胞的CAR表达水平比原pCDH载体的提高了200多倍,并表现出显著增强的针对胃癌细胞SGC-7901的杀伤活性。
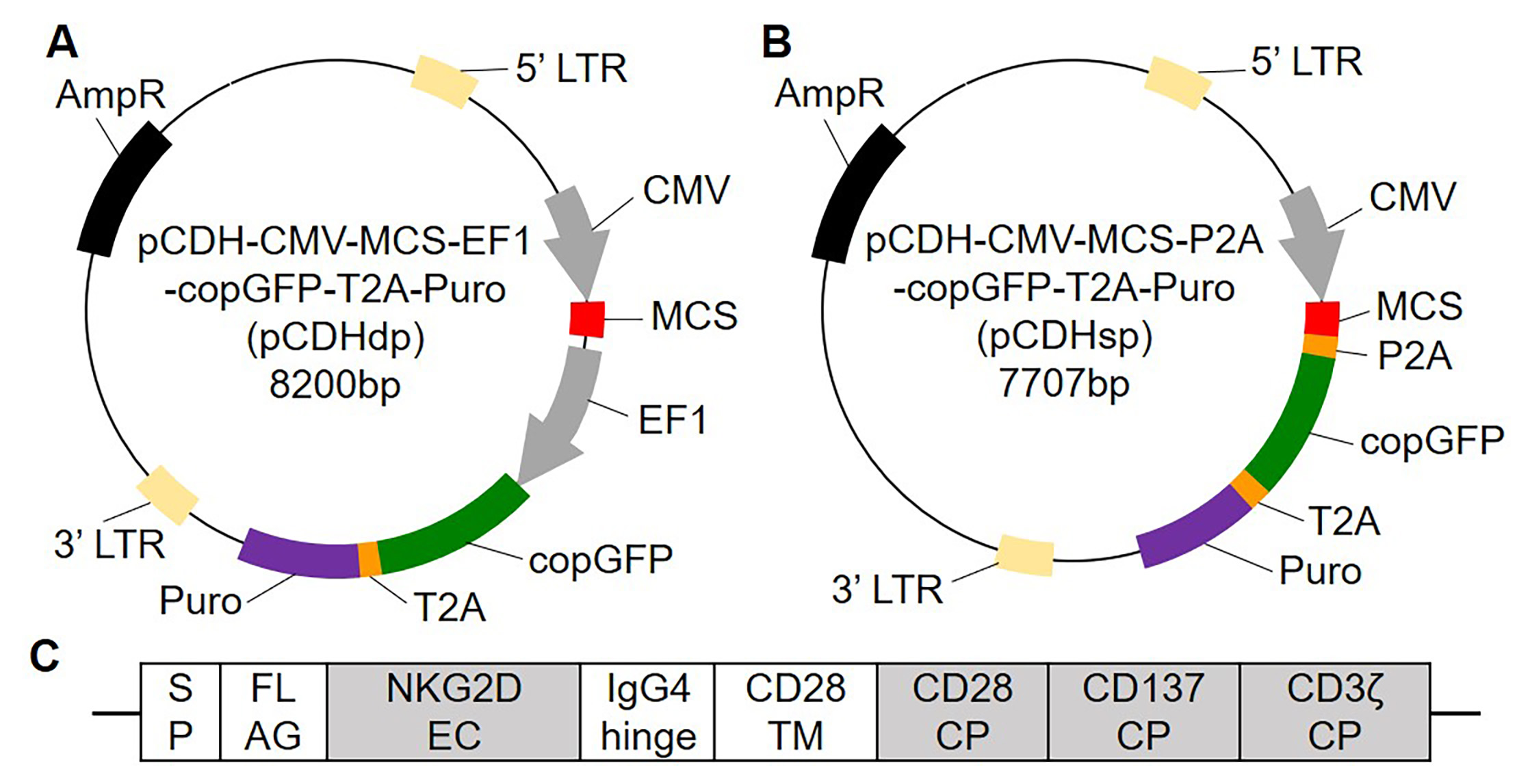
图1. 原始pCDH慢病毒载体(A)的示意图,优化后的pCDH慢病毒载体(B)以及基于NKG2D的嵌合抗原受体(C)的示意图。
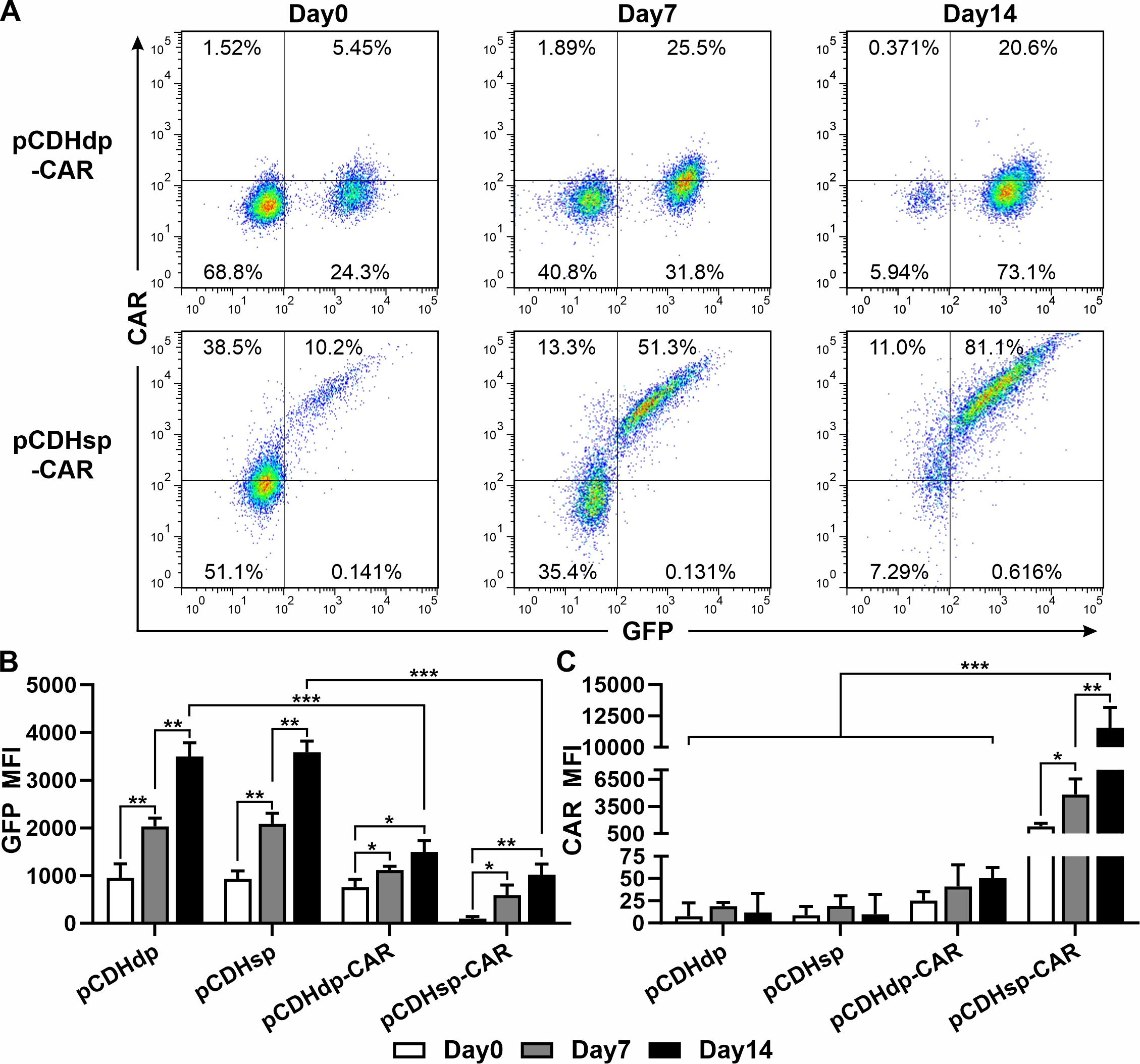
图2. NK92细胞通过转染不同pCDH慢病毒载体后GFP和CAR的表达,通过流式细胞术评估。(A)在抗性筛选期间,转染pCDHdp-CAR和pCDHsp-CAR的NK92细胞中GFP和CAR的流式细胞术分析。(B-C)在抗性筛选期间,转染的NK92细胞中GFP(B)和CAR(C)的平均荧光强度(MFI)。Day0,抗性选择开始前的一天。Day7/Day14,抗性选择开始后的第7天和第14天。
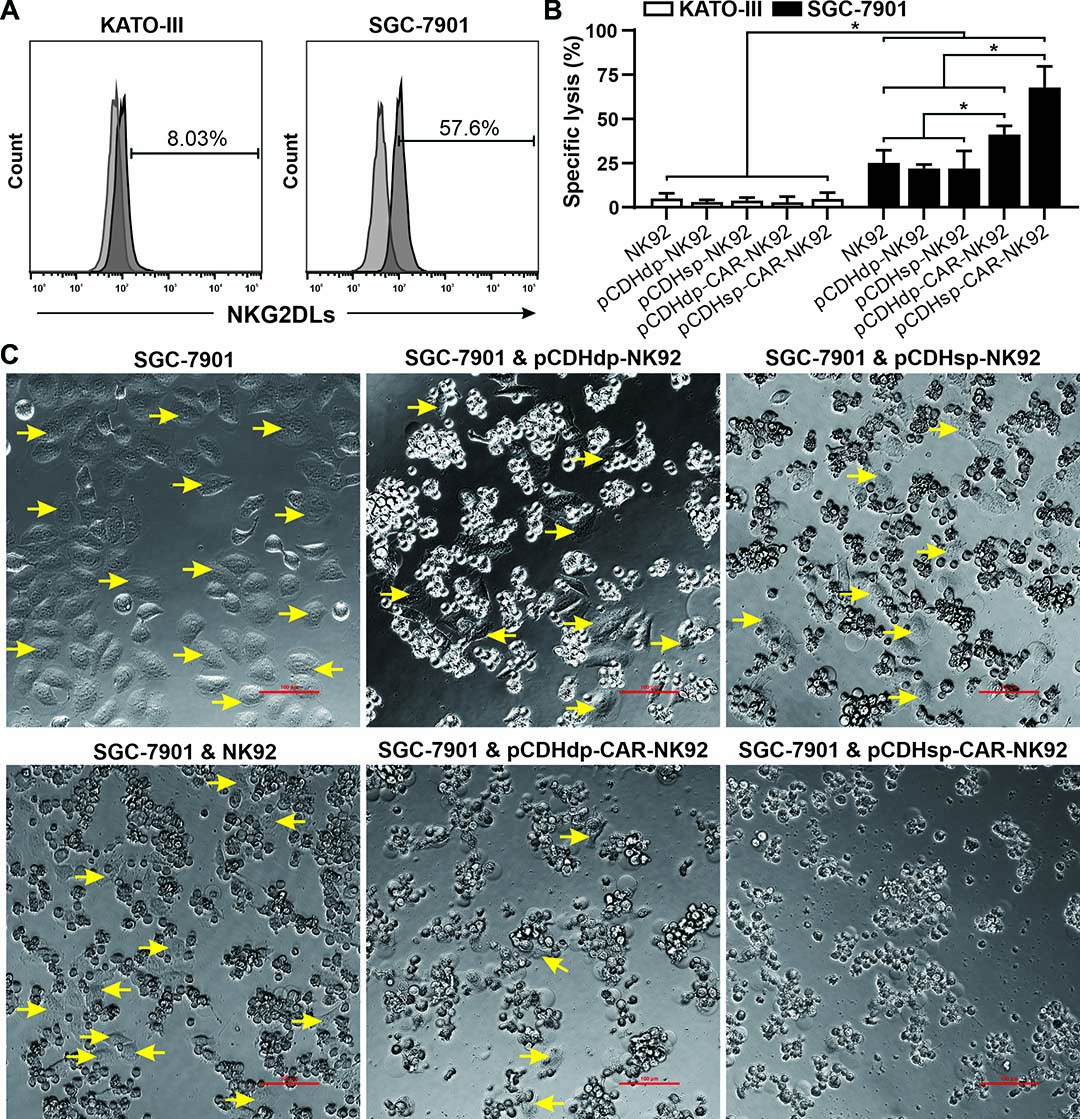
图3. 稳定转染的NK92细胞中CAR介导的细胞毒活性。 (A)通过流式细胞术评估人胃癌细胞株KATO-III和SGC-7901中NKG2D配体(NKG2DLs)的表面表达。(B)细胞毒性实验测量不同工程化修饰NK92细胞对两种靶细胞的杀伤活性。(C)未转染和转染的NK92细胞对SGC-7901细胞的细胞毒作用的显微观察。壁附癌细胞由黄色箭头标示。
【研究意义】
该研究表明,优化后的单启动子慢病毒载体pCDHsp可有效提升CAR在NK细胞中的表达水平,可作为NK定制化(NK-tailored)载体使用。使用该载体和相应制备方法可提供了质量更优更均一的CAR-NK细胞,从而大幅提高了CAR-NK细胞的肿瘤杀伤活性。这一策略将有助于CAR-NK细胞疗法转化到临床,为肿瘤患者带来新的希望。
(文/郭长江 图/郭长江)
